Denne guiden er ment for deg som båteier for å gi deg en grunnleggende forståelse av hva korrosjon er, hva som forårsaker og påvirker korrosjon, samt hjelpe deg å avgjøre hvilket anodemateriale du bør velge på din båt.
Av de mange kompliserte emnene en båteier må sette seg inn i er kanskje korrosjon det som er mest forvirrende. Korrosjon er en prosess som gjør at metallet oksiderer og kan forårsake problemer både når det kommer til vedlikehold av båten og sikkerhet ombord. Visse typer korrosjon kan ha store økonomiske konsekvenser for deg. Det er derfor viktig å benytte gode metoder for korrosjonsbeskyttelse sammen med fornuftige valg av materialer.
Hva er korrosjon?
Korrosjon er en elektrokjemisk prosess som gjør at metalliske materialer (metaller og legeringer) går i oppløsning (oksiderer) når de utsettes for et fuktig miljø. Den vanligste formen for korrosjon skjer når metaller er i kontakt med vann.
En av de mest kjente formene for korrosjon er rust; jern brytes ned og oksiderer tilbake til sin naturlige stabile tilstand, og får et rødbrunt belegg som dannes på overflaten når jernet reagerer med oksygen.
Korrosjonsmekanisme
Metallatomene på overflaten gir opp elektroner og blir positivt ladende ioner som oppløses i vannet eller elektrolytten (en væske som kan lede strøm). Elektroner strømmer gjennom metallet fra korrosjonsområdet til andre områder i nærheten, der de danner negative ioner i vannet. De positive ionene strømmer gjennom vannet og kombineres med de negative ionene som strømmer i motsatt retning.
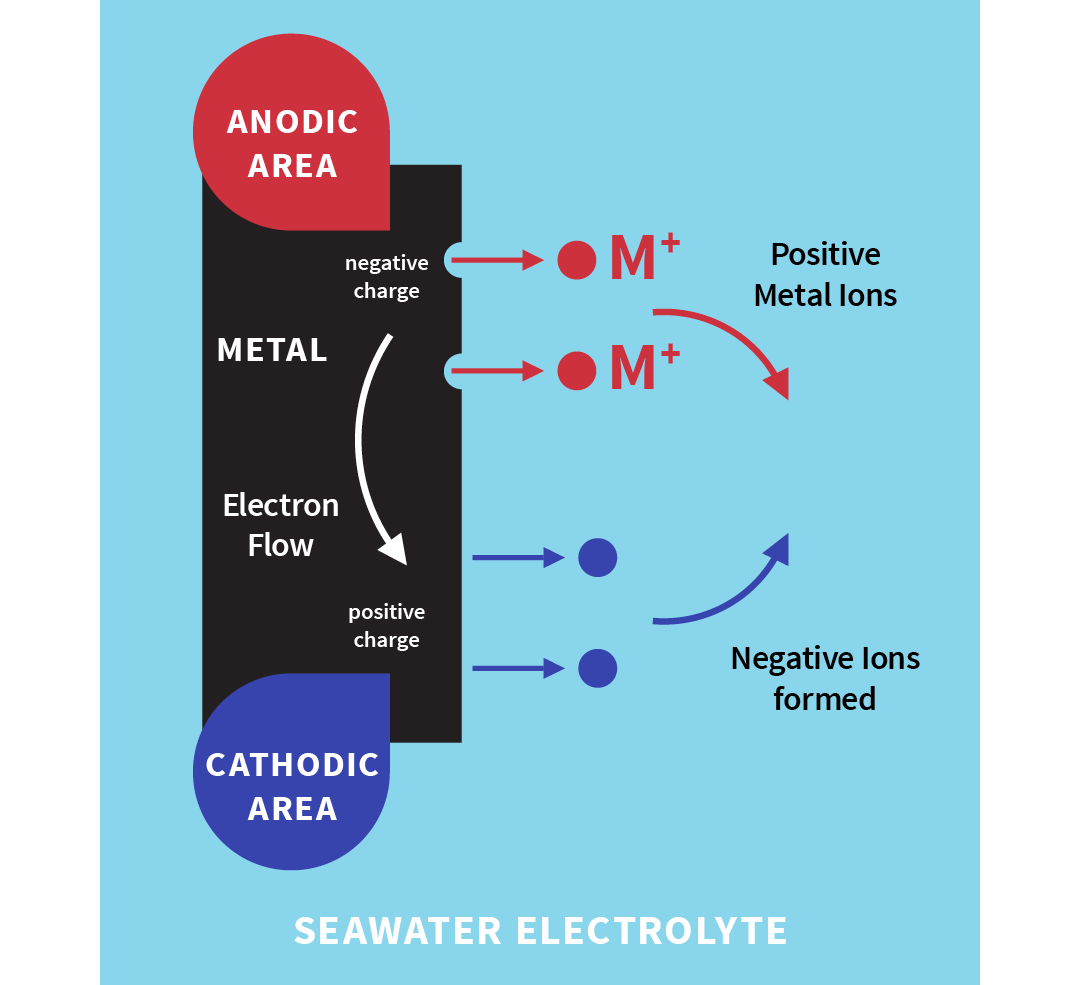
Illustrasjon: Korrosjonsmekanisme
Som vist på illustrasjonen over, kan du se at det er elektrisitet mellom lokaliserte områder på metalloverflaten, noe som resulterer i metall tap (korrosjon) i de anodiske områdene. Det er kun elektroner som blir gitt opp ved de katodiske områdene, så i disse områdene er det ikke noe metall som går tapt. De katodiske områdene er faktisk beskyttet.
Galvanic corrosion
Denne korrosjonsformen skjer dersom to ulike metaller er i kontakt (eksempelvis kobber og stål) og samtidig er omgitt av elektrolytt/saltvann. Elektroner strømmer fra metallet som er negativt ladet (anoden) til metallet som er positivt ladet (katoden). Det mest uedle metallet vil virke som en anode og løses elektrokjemisk, mens det skjer en reduksjonsreaksjon på overflaten av det edlere metallet.
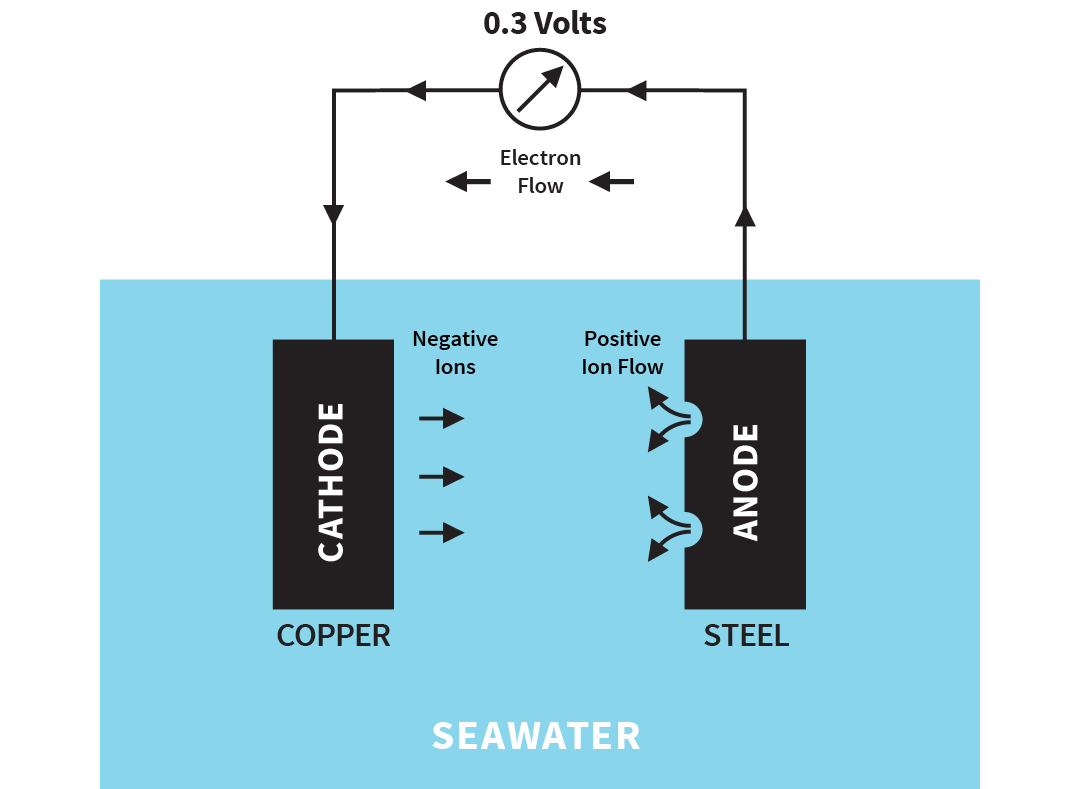
Illustration of galvanic corrosion
Spenningen som genereres mellom kobber og stål vil være 0,3 volt. Kretsen fullføres ved tap av positivt ladede ioner, fra anoden til elektrolytten, og de negativt ladede ionene ved katoden. Denne frigjøringen av små partikler (ioner) i vannet er mye raskere enn med et metall alene og er begrenset til stålets korrosjon. Katodematerialet (kobber) er beskyttet.
Offeranode
Hvis du vil beskytte begge typene metall må du legge til et tredje mer aktivt metall. Det vanligste metallet er sink, selv om magnesium og aluminium også kan brukes. Offeranoden består av et mindre edelt metall enn stål og vil korrodere, mens stålet bevares. Dette aktive metallet fungerer da som anoden for begge metaller. Sinket eller aluminiumet ofrer seg for å beskytte de to andre metallene, derav begrepet offeranode.
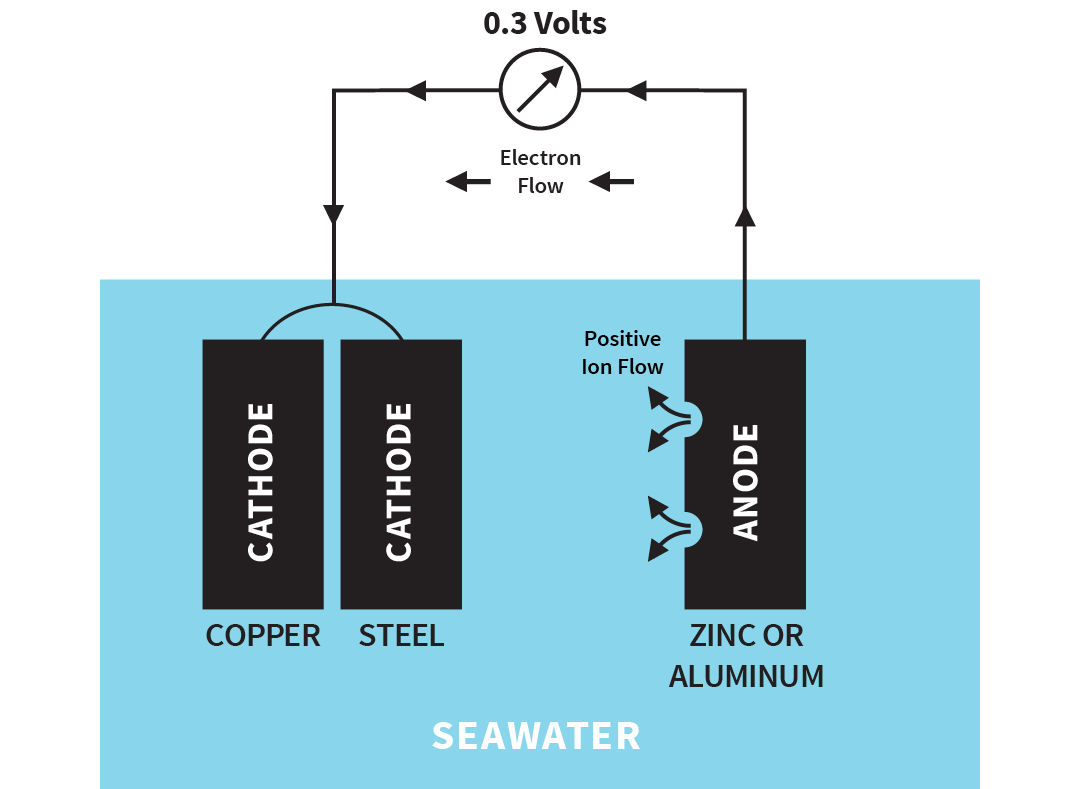
Illustrasjon: Offeranode
Hvorfor korroderer noen metaller mer enn andre?
Alle metaller har en tendens til å bli oksidert (korrodert), noen lettere enn andre. Den relative hastigheten ser du på den galvaniske spenningsrekken:
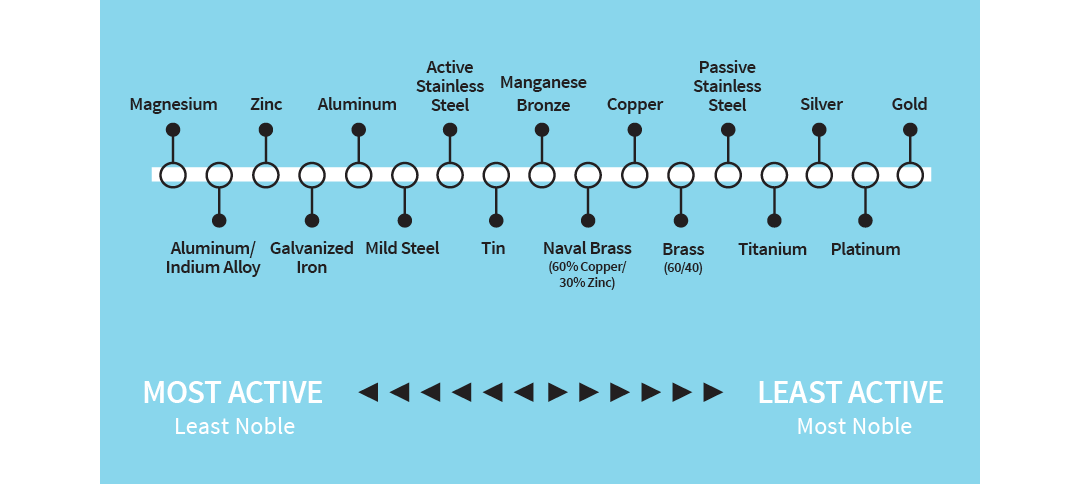
Illustrasjon: Den galvaniske spenningsrekken
Hvilke faktorer påvirker korrosjon?
Vær oppmerksom på at noen av disse faktorene kan variere mikroskopisk på overflaten av metallet.
- Ledningsevne for elektrolytter – sjøvann er en god leder, mens ferskvann er en dårlig leder, noe som betyr at korrosjon er et større problem i sjøvann.
- Mengde oksygen – generelt øker korrosjonshastigheten proporsjonalt med mengden oksygen i vannet. Sprekker og områder som er områder sultet for oksygen blir imidlertid anodiske og korroderer også.
- Forurensing – forurensede stoffer øker korrosjon.
- Vannets strømningshastighet – vil øke korrosjonshastigheten. Pittingkorrosjon blir imidlertid redusert på rustfritt stål.
- Temperatur – høyere temperatur øker korrosjonshastigheten, omtrent en dobling for hver 10°C/18°F.
- Belastning – metall under strekkbelastning (strukket) i kombinasjon med korrosjon kan plutselig svikte på grunn av spenningskorrosjon.
- Mikroorganismer – det finnes forskjellige typer mikroorganismer som kan bidra til korrosjon, enten ved å fjerne beskyttelse eller ved å forårsake et etsende miljø.
Areal og vekt på anoder
Overflatearealet til offeranodene bestemmer hvor mye beskyttelse (strømstyrke) anodene får, mens vekten bestemmer hvor lenge anodene vil vare. Ulike anoder har forskjellig kWh kapasitet (Amp Timer).
Forhold mellom katode og anode
Forholdet mellom arealet av den katodiske (beskyttende) overflaten og den anodiske (korroderende) overflaten er kritisk i galvanisk korrosjon. Jo mindre område der anoden gir fra seg materiale, desto raskere vil det vil korrosjon oppstå. Ideelt sett bør det anodiske området være mye større enn det katodiske området, men det er ikke praktisk mulig på en båt. Likevel kan dette forholdet kan forbedres ved å eksempelvis smøre vanntett epoxyprimer på den katodiske overflaten.
Galvanisk korrosjon via jordingskabelen
Tilkobling til landstrøm kobler jordingen din til nabobåtene. Hvis disse båtene ikke har egnede anoder, vil du være den som beskytter dem – noe som forårsaker rask slitasje av anodene dine. Se diagrammet nedenfor:
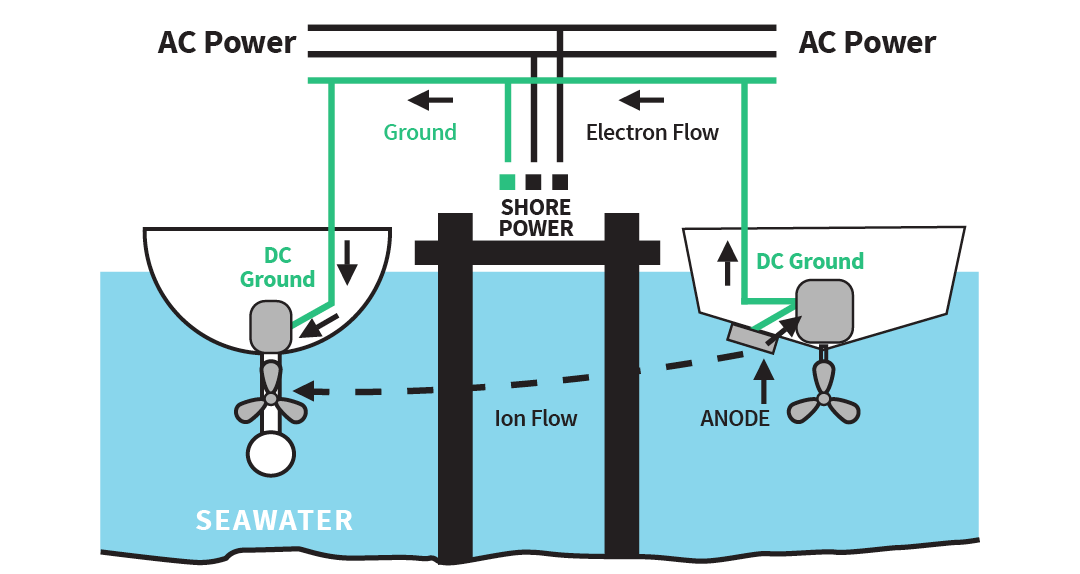
Illustrasjon: Galvanisk korrosjon via jordingskabel
Galvanisk isolator
En galvanisk isolator er en enhet som er installert i jordledningen (grønn/gul) for å blokkere direkte galvaniske strømmer, men likevel lar vekselstrøm passere.
NB: forsikre deg om at den galvaniske isolatoren du bruker er klassifisert for den effekten du bruker, f.eks. 30A eller 50A. Galvaniske isolatorer av dårlig kvalitet har vært kjent for å starte brann, så det er lurt å skaffe seg en som er ISO sertifisert og CE-merket for å sikre at den er ordentlig testet.
Krypstrøm og galvanisk korrosjon
Krypstrøm og galvanisk korrosjon er en usynlig fiende i båt. Her blir korrosjon forårsaket av en ekstern strøm fra et batteri eller en annen likestrømskilde (DC). Vanlige årsaker kan blant annet være strømførende og dårlig isolerte ledninger i kjølsvinet (nivåbryter, lensepumpe, ekkolodd, osv.), dårlig kvalitet på 12V jord (minus) som gir spenningsforskjeller mellom ulike metalldeler/skrog-gjennomføringer, og/eller utstyr/kabler som er installert feil.
Påtrykt strømsystem
I stedet for å bruke en offeranode for å generere en beskyttende spenning kan en likestrømkilde brukes. Prinsippet er det samme, men strømmen overvåkes og justeres av systemet. Et ikke-korroderende materiale brukes til anodene.
Fordelen med et påtrykt strømsystem er at det kan utvikle høyere spenninger enn en offeranode. Ulempen er at det kan «overbeskytte».
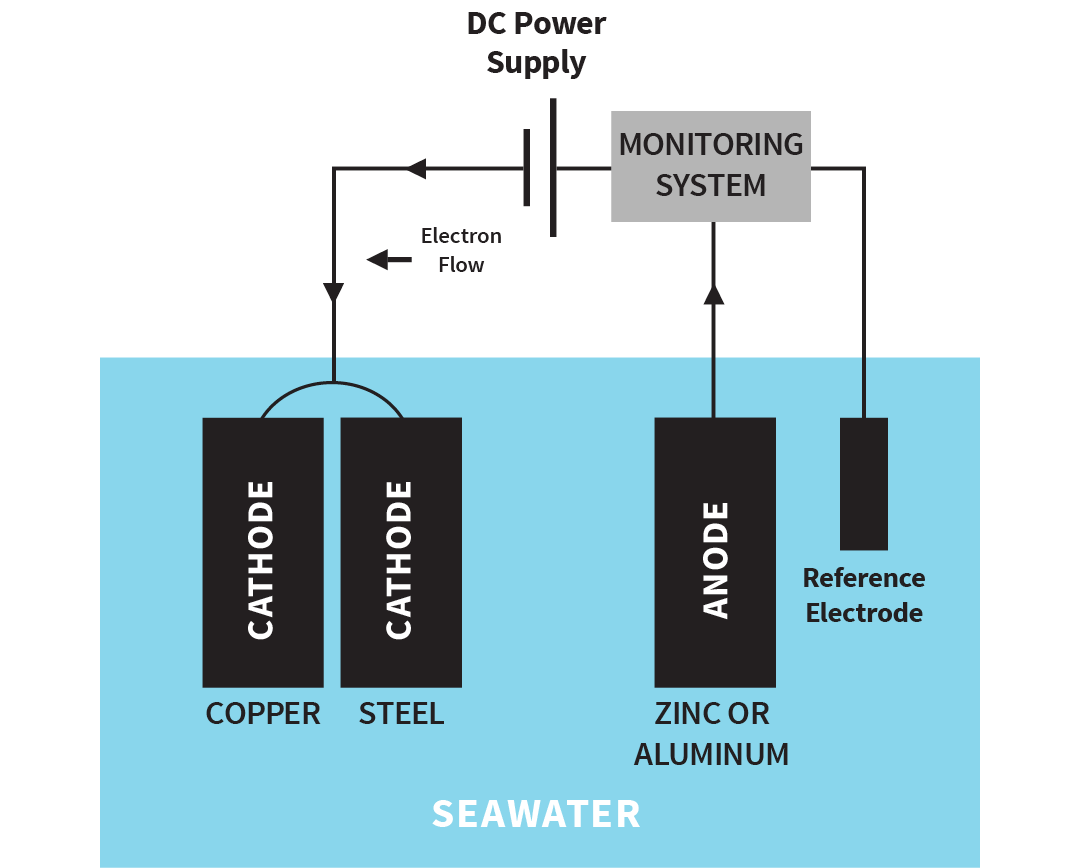
Illustrasjon: Påtrykt strømsystem
Kobling
Alt elektrisk utstyr og beslag av metall under vann skal kobles til samme jordpunkt (kobles til batteriets minuspol). Dette sikrer at alle komponentene har samme spenning, og forhindrer krypstrøm.
Offeranode: Materialer
| SINK | ALUMINIUM | MAGNESIUM | |
| SPENNING (SJØVANN) |
-1.03 V | -1.1 V | -1.5 V |
| RELATIV LIV (SINK=100 SAMME STØRRELSE) |
100 | 150 | 30 |
| RELATIV TETTHET (SINK=100) |
100 | 42 | 27 |
| MIL. SPESIFIKASJON | MIL-A-18001 | MIL-A-24779 | MIL-A-21412 |
Sinkanoder
Sink er det vanligste materialet som brukes. Sinkanoder er ikke veldig nyttige i ferskvann og kan slutte å virke etter bare noen få måneder hvis de ikke er laget i samsvar med MIL-spesifikasjonene. Sinkanoder bør byttes regelmessig, selv om de ser ok ut. Husk at hvis en anode ikke slites, fungerer den ikke!
Aluminiumanoder
Aluminiumslegeringen som brukes i anoder er veldig forskjellig fra vanlig aluminium. Den inneholder omtrent 5% sink og et spor av Indium, som forhindrer oppbygging av et beskyttende oksidlag på aluminiumens overflate. Anodelegering av aluminium gir mer beskyttelse og varer lenger enn sink (se diagram). Den vil fortsette å jobbe i ferskvann og er trygg for bruk i saltvann. Aluminium er den eneste anoden som er trygg for alle bruksområder.
Magnesiumanoder
Magnesium er det mest aktive metallet på den galvaniske skalaen. Det kan brukes i ferskvann, men med forsiktighet. Magnesium kan overbeskytte aluminiumskrog eller drev i saltvann, brakkvann og til og med forurenset ferskvann, noe som får overflatebehandlingen til å løftes med korrosjon som resultat. Selv noen få timer i vann kan forårsake alvorlig skade.
Which anode material is right for your boat?
|
INNENBORDS |
UTENBORDS | ||||
|
SKROG |
TRE | FIBERGLASS | ALUMINIUM | STÅL | ALLE |
|
FERSKVANN (RENT) |
ALUMINIUM | ALUMINIUM/ MAGNESIUM |
ALUMINIUM | ALUMINIUM/ MAGNESIUM |
ALUMINIUM/ MAGNESIUM |
| FERSKVANN (FORURENSET) | ALUMINIUM | ALUMINIUM | ALUMINIUM | ALUMINIUM | ALUMINIUM |
|
BRAKKVANN |
ALUMINUM/SINK | ALUMINUM/SINK | ALUMINUM/SINK | ALUMINUM/SINK | ALUMINIUM |
|
SALT |
ALUMINUM/SINK | ALUMINUM/SINK | ALUMINUM/SINK | ALUMINUM/SINK | ALUMINIUM |
Anode – hva du bør gjøre, og hva du ikke bør gjøre
Gjør dette
- Bytt anoder når de er halvveis (50%) korroderte. En «slitasjeindikator»-anode vil hjelpe deg å fortelle deg når du skal bytte.
- Forsikre deg om at de har god elektrisk kontakt – fjern maling og rengjør monteringsflaten.
- Beskytt trimplanene hver for seg (ikke koble de sammen). Selv om de vanligvis er laget av rustfritt stål kan de fremdeles korrodere og trenger offeranoder.
- Sørg for å bruke nye bolter og fester på anodene (følger vanligvis med anoden) – selv rustfrie bolter svikter på grunn av korrosjon.
- Husk at utstyr som skal beskyttes av anoder er avhengig av at anodene er i vannet sammen med det metallet du vil at anodene skal beskytte.
Ikke gjør dette
- Ikke smør primer eller bunnstoff på anodene. Da vil de ikke fungere!
- Ikke bland anodetyper – aluminiumanoder vil prøve å beskytte sinkanoder på samme koblingskrets.
- Ikke benytt noe annet enn originale anoder på hekkaggregat – da er du alltid sikker på at du får riktig beskyttelse.
Kjappe fakta om maritime materialer
Aluminum
Riktig valgt aluminiumslegering er et utmerket materiale for maritimt bruk. Metallet veier lite, er sterkt og lett å jobbe med. Videre har aluminium stort sett en utmerket korrosjonsbestandighet på grunn av sin evne til raskt å danne en beskyttende oksidasjonsfilm på overflaten. Ubeskyttet kan det bli utsatt for lokalisert korrosjon, også kalt pittingkorrosjon, hvor området blir dekket av et grovt hvitt pulver. Denne formen for korrosjon er utbredt for alle metaller som lager oksidsjikt, men disse er vanligvis overfladiske og ikke skadelige. Anodisering vil normalt sett eliminere dette.
Samtidig er aluminium veldig aktiv på den galvaniske skalaen (-.76- 1.00 volt), noe som gjør den utsatt for galvanisk korrosjon når den er i kontakt med mer edle metaller. Beslag av bronse, messing eller monel bør unngås eller isoleres for å forhindre galvanisk korrosjon. Fester av rustfritt stål (316) anbefales. Aluminium kan overbeskyttes av for mye spenning fra magnesiumanoder i saltvann, brakkvann eller forurenset ferskvann.
Messing
Messing er en legering av kobber og sink. Generelt sett ikke anbefalt for maritim bruk. Messing er utsatt for avsinking, som er galvanisk korrosjon av sink fra legeringen, noe som etterlater messingkomponentene porøse. Men det finnes avsinkingsbestandig messing som anbefales for maritime miljøer. Vær oppmerksom på at manganbronse er messing, ikke en ekte bronse, og trenger galvanisk beskyttelse hvis den brukes under vann.
Bronse
Bronse er en legering av kobber med lite eller ingen sink. Autentisk bronse er robust og ekstremt motstandsdyktig mot korrosjon, både i atmosfæren og i vann. Bronse kan inneholde tinn, aluminium, nikkel eller fosfor, men det beste og mest brukte er silisiumbronse. Benyttes i deler som skal være i maritimt miljø og/eller nedsenket i vann i lang tid.
Rustfritt stål
Rustfritt stål er et mye brukt, korrosjonsbestandig materiale. Rustfritt har sin korrosjonsbestandighet på grunn av krominnholdet, som danner en oksidfilm som tette overflaten mot angrep av korrosjon (materialet blir da referert til som passivt).
Hvis rustfritt stål isoleres slik at nytt oksygen ikke kommer til på overflaten, for eksempel under tetninger eller rur, mister det sin beskyttende oksidfilm og blir aktiv. Det vil da korrodere lett. Dette kan også forekomme i mikroskopiske sprekker som resulterer i nesten usynlig korrosjon, noe som kan forårsake plutselige skader som eksempelvis propellaksler som knekker uten forvarsel. Som et eksempel kan korrosjon innvendig i propellakslingens lagringer også være forårsaket av denne mangelen på oksygen i området og følgende nedbrytning eller hindringen av det rustfrie materialets evne til å bygge opp en beskyttende oksidfilm på overflaten som et resultat.
Skrog av tre
Treskrog er veldig utsatt for nedbrytning på grunn av forskjellige typer tresorter og korrosjon forårsaket av metallbeslag og fester. Fester av silikonbronse anbefales.
Glassfiber / komposittskrog
Med glassfiber og/eller komposittskrog anbefales bronsefester under vannlinjen. Advarsel: Karbonfiber (grafitt) er elektrisk ledende og kan forårsake galvanisk korrosjon mellom metallkomponenter i strukturen.
Referanser og nyttige lenker
- Korrosjon - Store Norske Leksikon av Geir Martin Haarberg
- Korrosjon - Båtboerforeningen (pdf)
- The truth about aluminum anodes - by Martin Wigg and Paul Fleury (pdf)
- Basics of corrosion - by Performance Metals (pdf)
- Sacrificial anodes FAQ - by Performance Metals (pdf)








